Машинное обучение помогло сгенерировать больше вариантов векторов для генной терапии
Американские ученые при помощи методов машинного обучения создали множество вариантов аденоассоциированного вируса, который часто используется в качестве доставляющего агента в генной терапии.
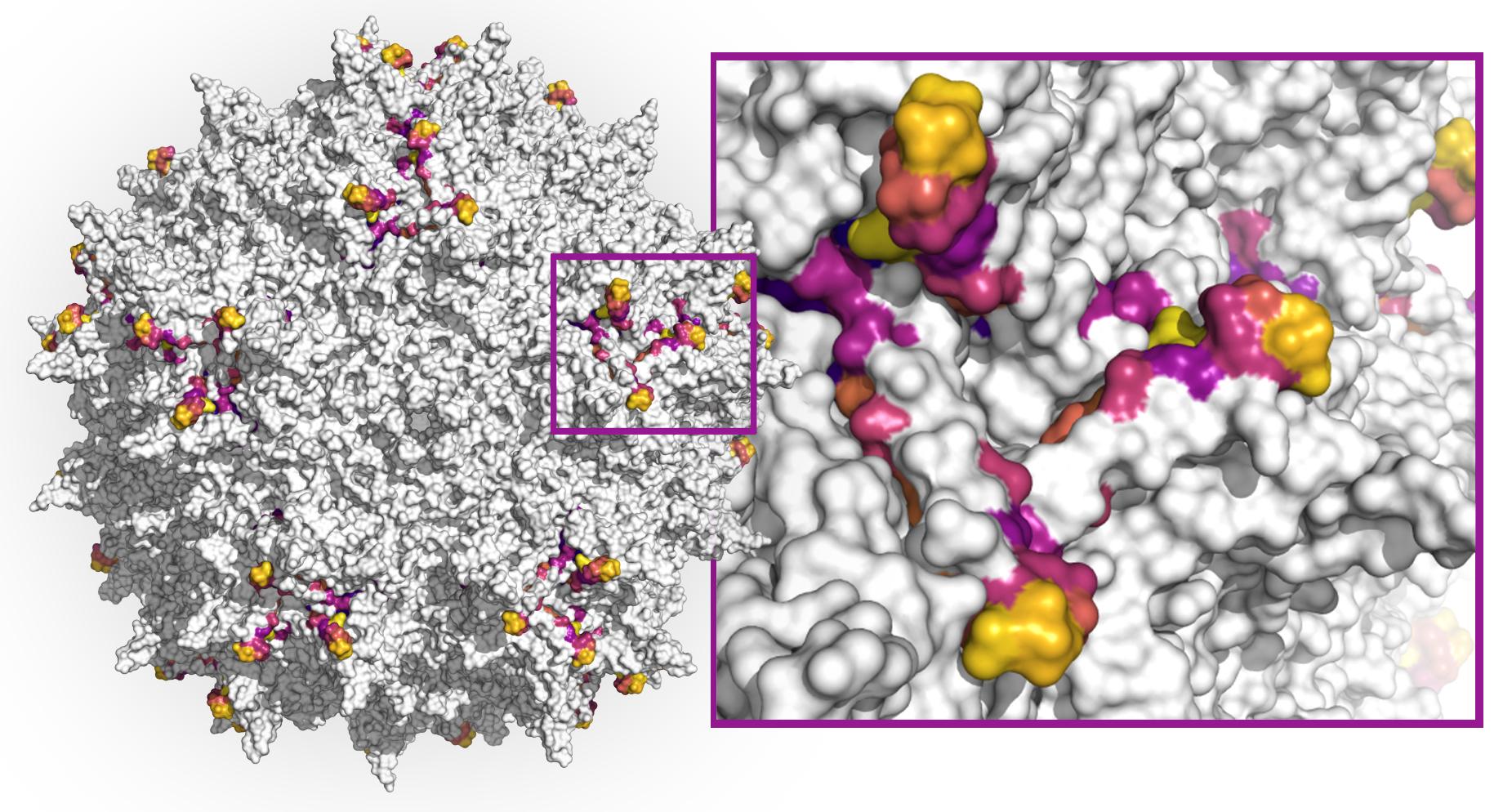
Примененные в ходе работы модели составили жизнеспособные частицы с большим количеством мутаций. Авторы опубликованной в Nature Biotechnology работы надеются, что разработанный ими метод станет важным инструментом для дальнейшей разработки векторов генной терапии.
Аденоассоциированный вирус часто используется как вектор (носитель) для генной терапии: для этого вирус лишают части его собственной генетической информации и заменяют ее на необходимую. Именно аденоассоциированный вирус стал основой для первого одобренного к медицинскому применению генотерапевтического препарата, и еще несколько подобных средств проходят клинические испытания.
В ходе создания векторов для терапии биоинженеры стремятся изменить природный капсид, внешнюю белковую оболочку вируса, внутри которой спрятан генетический материал, и придать ему желаемые свойства. Например, именно белки капсида определяют, будет ли терапия специфична к каким-либо тканям организма. Чтобы создать средство, нацеленное на определенную ткань или орган, необходимо получить вирусную частицу, капсид которой будет обладать повышенной способностью инфицировать эту ткань. Кроме того, иммунная система многих людей может быть уже знакома с природным аденоассоциированным вирусом и будет активно подавлять частицы, на самом деле предназначенные для лечения. Чтобы этого не происходило, необходимо сделать капсид как можно более неузнаваемым для иммунитета.
В арсенале молекулярных биологов есть ряд методов для изменения капсида, например, случайное перемешивание участков генома, кодирующих капсидные белки, или внесение случайных мутаций. Однако далеко не все получаемые генетические варианты жизнеспособны (то есть могут образовать вирусные частицы), а многие из удачных капсидов по-прежнему слишком похожи на природные варианты.
Ученые из Гарвардского университета под руководством Эрика Келсика (Eric Kelsic) решили при помощи машинного обучения создать модель, которая бы генерировала дизайн вирусных частиц и оценивала их функциональность. Для работы исследователи выбрали участок длиной в 28 аминокислот, который включает в себя распознаваемые антителами участки.
Сначала ученые создали датасет из вирусной генетической информации для тренировки модели. Для этого ученые сначала вносили либо по одной аминокислотной замене в каждую из 28 выбранных позиций в капсидном белке, либо случайным образом от двух до десяти мутаций на этом участке. В полученных двух группах вирусных частиц жизнеспособность составила 58 и 10 процентов, соответственно. Затем авторы работы совместили случайным образом мутации из этих двух групп и получили третью. По-разному комбинируя последовательности из трех групп, исследователи получили три набора данных разного размера для обучения модели. Для каждого из трех наборов ученые применили три вида архитектуры модели: логистическию регрессию, сверточную нейросеть и реккурентную нейросеть.
Исследователи получили два множества последовательностей: те, которые были оценены алгоритмами, и те, которые были ими составлены. Каждая из последовательностей несла от 5 до 29 мутаций. Ученые синтезировали 201426 из них и оценили их жизнеспособность экспериментально.
Опираясь на базовую модель, исследователи ожидали, что 62,5 процента составленных при помощи машинного обучения капсидов будут функциональными, и что ни один капсид с более чем 21 мутацией на заданном участке не будет жизнеспособен. В действительности алгоритмы хорошо справились с дизайном новых белков: 58,1 процент составленных ими последовательностей (110689 вариантов) сформировали функциональные капсиды. Самое главное, что при этом у 57.348 жизнеспособных вариантов оказалось от 12 до 29 мутаций на заданном участке, что сильно отличило их от природных капсидов (и превзошло ожидания авторов работы). Нейросетям неплохо поддалась и вторая задача - оценка жизнеспособности: точность предсказания почти достигла ста процентов для вариантов, несущих до шести мутаций на заданном участке по сравнению с природным вирусом.
Авторы работы отмечают, что обнаруженные в ходе исследования варианты аденоассоциированного вируса - многообещающие кандидаты в векторы. Возможно, новые частицы будут обладать необходимыми разным исследователям функциями: например, повышенным тропизмом к клеткам определенных тканей, или их будет легко производить в промышленных масштабах.
Препарат на основе вектора из аденоассоциированного вируса стал первым одобренным FDA геннотерапевтическим средством. Успешно прошли и клинические испытания генной терапии гемофилии В; подобную терапию гемофилии А (и тоже с аденоассоциированным вирусом в качестве вектора) назвали эффективной и безопасной в долгосрочной перспективе.
Автор: Вера Сысоева
Ссылка на источник

Примененные в ходе работы модели составили жизнеспособные частицы с большим количеством мутаций. Авторы опубликованной в Nature Biotechnology работы надеются, что разработанный ими метод станет важным инструментом для дальнейшей разработки векторов генной терапии.
Аденоассоциированный вирус часто используется как вектор (носитель) для генной терапии: для этого вирус лишают части его собственной генетической информации и заменяют ее на необходимую. Именно аденоассоциированный вирус стал основой для первого одобренного к медицинскому применению генотерапевтического препарата, и еще несколько подобных средств проходят клинические испытания.
В ходе создания векторов для терапии биоинженеры стремятся изменить природный капсид, внешнюю белковую оболочку вируса, внутри которой спрятан генетический материал, и придать ему желаемые свойства. Например, именно белки капсида определяют, будет ли терапия специфична к каким-либо тканям организма. Чтобы создать средство, нацеленное на определенную ткань или орган, необходимо получить вирусную частицу, капсид которой будет обладать повышенной способностью инфицировать эту ткань. Кроме того, иммунная система многих людей может быть уже знакома с природным аденоассоциированным вирусом и будет активно подавлять частицы, на самом деле предназначенные для лечения. Чтобы этого не происходило, необходимо сделать капсид как можно более неузнаваемым для иммунитета.
В арсенале молекулярных биологов есть ряд методов для изменения капсида, например, случайное перемешивание участков генома, кодирующих капсидные белки, или внесение случайных мутаций. Однако далеко не все получаемые генетические варианты жизнеспособны (то есть могут образовать вирусные частицы), а многие из удачных капсидов по-прежнему слишком похожи на природные варианты.
Ученые из Гарвардского университета под руководством Эрика Келсика (Eric Kelsic) решили при помощи машинного обучения создать модель, которая бы генерировала дизайн вирусных частиц и оценивала их функциональность. Для работы исследователи выбрали участок длиной в 28 аминокислот, который включает в себя распознаваемые антителами участки.
Сначала ученые создали датасет из вирусной генетической информации для тренировки модели. Для этого ученые сначала вносили либо по одной аминокислотной замене в каждую из 28 выбранных позиций в капсидном белке, либо случайным образом от двух до десяти мутаций на этом участке. В полученных двух группах вирусных частиц жизнеспособность составила 58 и 10 процентов, соответственно. Затем авторы работы совместили случайным образом мутации из этих двух групп и получили третью. По-разному комбинируя последовательности из трех групп, исследователи получили три набора данных разного размера для обучения модели. Для каждого из трех наборов ученые применили три вида архитектуры модели: логистическию регрессию, сверточную нейросеть и реккурентную нейросеть.
Исследователи получили два множества последовательностей: те, которые были оценены алгоритмами, и те, которые были ими составлены. Каждая из последовательностей несла от 5 до 29 мутаций. Ученые синтезировали 201426 из них и оценили их жизнеспособность экспериментально.
Опираясь на базовую модель, исследователи ожидали, что 62,5 процента составленных при помощи машинного обучения капсидов будут функциональными, и что ни один капсид с более чем 21 мутацией на заданном участке не будет жизнеспособен. В действительности алгоритмы хорошо справились с дизайном новых белков: 58,1 процент составленных ими последовательностей (110689 вариантов) сформировали функциональные капсиды. Самое главное, что при этом у 57.348 жизнеспособных вариантов оказалось от 12 до 29 мутаций на заданном участке, что сильно отличило их от природных капсидов (и превзошло ожидания авторов работы). Нейросетям неплохо поддалась и вторая задача - оценка жизнеспособности: точность предсказания почти достигла ста процентов для вариантов, несущих до шести мутаций на заданном участке по сравнению с природным вирусом.
Авторы работы отмечают, что обнаруженные в ходе исследования варианты аденоассоциированного вируса - многообещающие кандидаты в векторы. Возможно, новые частицы будут обладать необходимыми разным исследователям функциями: например, повышенным тропизмом к клеткам определенных тканей, или их будет легко производить в промышленных масштабах.
Препарат на основе вектора из аденоассоциированного вируса стал первым одобренным FDA геннотерапевтическим средством. Успешно прошли и клинические испытания генной терапии гемофилии В; подобную терапию гемофилии А (и тоже с аденоассоциированным вирусом в качестве вектора) назвали эффективной и безопасной в долгосрочной перспективе.
Автор: Вера Сысоева
Ссылка на источник