ФЕНБЕНДАЗОЛ против МЕБЕНДАЗОЛА при раке поджелудочной железы - что лучше?
Краткое содержание исследования:
Так что же лучше? Фенбендазол? Или его родственный препарат, одобренный FDA и гораздо более дорогой мебендазол? Итальянская команда протестировала их лицом к лицу и получила неожиданный ответ.
Ответ: Это зависит от используемой дозы и типа рака.
При этом разница довольно незначительна.
Для больного раком наиболее важным является наличие и доступ к этим лекарствам. Если не можешь получить одно, возьми другое. Но убедитесь, что вы сможете получить хотя бы один из них. Потому что однажды они могут спасти вам жизнь.
(при раке поджелудочной железы победителем стал фенбендазол)
UPD Примечательно, что для двух производных фенбендазола и мебендазола анализ прогнозирования мишеней выявил несколько молекулярных мишеней, связанных с раком, имеющих очень высокие оценки вероятности, что позволяет предположить полифармакологические профили этих препаратов». Оба препарата повышают уровень супрессора опухолей p53, который нарушен в 50-60% случаев всех видов рака и еще больше нарушен у тех, кто получил вакцины Pfizer или Moderna COVID-19 мРНК и у кого развился ТУРБО-РАК.
ВЕРДИКТ: Фенбендазол обладает более высокой эффективностью в убийстве раковых клеток при более высоких дозах при раке поджелудочной железы, колоректальном раке и параганглиомах (по сравнению с мебендазолом и альбендазолом).

Скрининг антигельминтных средств на основе бензимидазола и их энантиомеров в качестве повторно используемых лекарственных препаратов для лечения рака
Повторное использование одобренных непротивоопухолевых препаратов представляет собой многообещающую и доступную стратегию, которая может помочь расширить репертуар эффективных противораковых препаратов. Антигельминтики на основе бензимидазола являются противопаразитарными препаратами, широко используемыми как в медицине, так и в ветеринарии. Соединения бензимидазола рассматриваются для повторного использования в связи с противоопухолевой активностью, проявляемой некоторыми представителями этого семейства. В этом исследовании мы изучили влияние большого ряда антигельминтиков на основе бензимидазола (и некоторых энантиомерно чистых форм тех, которые содержат стереогенный центр) на жизнеспособность различных линий опухолевых клеток, полученных из параганглиомы, рака поджелудочной железы и колоректального рака. Флубендазол, парбендазол, оксибендазол, мебендазол, альбендазол и фенбендазол продемонстрировали наиболее последовательные антипролиферативные эффекты, демонстрируя значения IC50 в низком микромолярном диапазоне или даже в наномолярном диапазоне. Оценка in silico их физико-химических, фармакокинетических и медицинских химических свойств также предоставила полезную информацию, связанную с химическими структурами и потенциалом этих соединений. Кроме того, ввиду потенциального повторного использования этих препаратов в терапии рака и принимая во внимание, что фармацевтически активные соединения могут иметь различные механизмы действия, мы выполнили прогнозирование мишени in silico для оценки полифармакологии этих бензимидазолов, что выявило ранее неизвестные молекулярные мишени, имеющие отношение к раку.

1. Введение
Современные подходы к лечению рака по-прежнему в значительной степени основаны на традиционной химиотерапии, эффективность которой часто снижается из-за развития лекарственной устойчивости, связанной с активацией механизмов, способствующих выживанию раковых клеток, метастатическому распространению и иммунному ускользанию, а также оттоку и инактивации лекарств [ 1 ]. Таким образом, для улучшения результатов лечения онкологических пациентов необходимы новые и более эффективные препараты. К сожалению, открытие и разработка новых противораковых препаратов, обладающих как улучшенной эффективностью в отношении опухолей, так и низкой токсичностью в нормальных тканях, являются задачами длительного, дорогостоящего и часто сложного процесса, который может потерпеть неудачу на всех этапах клинических испытаний, необходимых перед одобрением препарата [ 2 , 3 ]. Интересно, что повторное использование непротивоопухолевых препаратов для использования в терапии рака представляет собой ценную и альтернативную стратегию, поскольку кандидаты на препараты имеют хорошо документированные фармакокинетические и фармакодинамические характеристики, а также хорошие профили безопасности, что может ускорить их одобрение и внедрение в клиниках [ 4 , 5 ]. Более того, разработка и маркетинг недорогих, уже одобренных продуктов для использования по другому терапевтическому показанию является уместной стратегией для обозначения орфанного препарата или для снижения расходов, которые системы здравоохранения должны нести для гарантированного доступа пациентов к терапии. В этой связи антигельминтики на основе бензимидазола входят в число непротивораковых препаратов, которые рассматривались в качестве кандидатов для повторного использования в онкологии из-за доклинических данных, подтверждающих их противоопухолевые свойства в нескольких клеточных и животных моделях [ 6 , 7 , 8 , 9 ]. В частности, несколько исследований показали, что некоторые члены семейства антигельминтиков на основе бензимидазола, такие как альбендазол, мебендазол и флубендазол, обладают замечательной противоопухолевой активностью при меланоме, лейкемии, медуллобластоме, раке молочной железы и колоректальном раке [ 10 , 11 , 12 , 13 , 14 , 15 , 16 ]. Кроме того, недавно мы сообщили, что парбендазол, мебендазол, фенбендазол и оксибендазол также проявляют противоопухолевые эффекты в клетках рака поджелудочной железы [ 17 ]. Стоит отметить, что, как и в случае с другими повторно используемыми препаратами [ 18 , 19 ], сообщалось о том, что несколько путей, которые имеют решающее значение в биологии рака, модулируются бензимидазолами, что объясняет их противоопухолевую активность [ 20 , 21 ]. В этой связи соединения, которые воздействуют на несколько целей, могут обладать повышенной эффективностью и способностью преодолевать приобретенную резистентность к традиционной химиотерапии.
Исходя из этих соображений, в настоящем исследовании мы изучили антипролиферативные эффекты более широкого ряда антигельминтиков на основе бензимидазола против панели клеточных линий, представляющих три различных опухоли, включая линии клеток рака поджелудочной железы (AsPC-1 и BxPC-3), параганглиомы (PTJ64i и PTJ86i) и колоректального рака (HT-29 и SW480), с целью расширения имеющегося арсенала химиотерапевтических агентов. Примечательно, что две уникальные клеточные линии PTJ64i и PTJ86i были ранее получены в нашей лаборатории от двух пациентов с параганглиомой [ 22 , 23 ], редкой опухолью, которая плохо реагирует на стандартную химиотерапию, для которой срочно требуются новые терапевтические агенты и которая может выиграть от обозначения орфанной. К сожалению, эта задача остается в значительной степени неизученной при параганглиоме, также из-за отсутствия коммерческих клеточных линий. Стоит отметить, что мы включили в серию тестируемых молекул две пары энантиомеров, полученных из соответствующих двух хиральных бензимидазолов (т. е. рикобендазола и оксфендазола), чтобы проанализировать, могут ли они оказывать различные эффекты на жизнеспособность вышеупомянутых линий раковых клеток на основе стереоселективного метаболизма, включающего этот органический каркас ( рисунок 1 ). В серии мы также тестировали антипролиферативную активность против паразитов новых формул солей бензимидазола, недавно лицензированных некоторыми из нас, которые продемонстрировали улучшенную биодоступность и растворимость in vivo, в исследованиях против вторичного кистозного эхинококкоза с использованием экспериментально инфицированных мышей [ 24 ]. Примечательно, что эти запатентованные соли были подготовлены для преодоления проблем, связанных с плохой растворимостью в воде бензимидазольного каркаса и соответствующей неустойчивой биодоступностью, как ранее исследовали и другие авторы с помощью нескольких стратегий, включая включение в циклодекстриновые комплексы [ 25 , 26 ], преобразование в растворимые пролекарства [ 27 ], характеристику и использование выбранных полиморфных форм и сольватов [ 28 ] и подготовку инновационных формул [ 29 ]. В дополнение к тестированию антипролиферативной активности мы также предсказали физико-химические свойства и предполагаемые молекулярные мишени для нашей серии бензимидазолов, используя подход in silico, для дальнейшего изучения полифармакологии этих соединений.
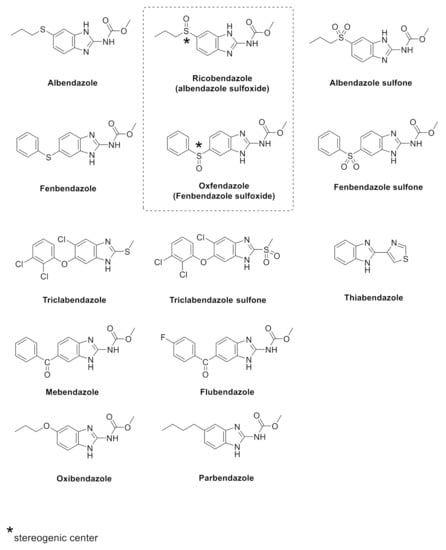
Рисунок 1. Структура проверенных бензимидазолов. Для хиральных соединений были получены и протестированы отдельные энантиомеры, ( R )-рикобендазол/( S )-рикобендазол и ( R )-оксфендазол/( S )-оксфендазол, соответственно.
2. Результаты и обсуждение
Эффекты 15 антигельминтиков на основе бензимидазола ( Рисунок 1 ) на жизнеспособность шести линий раковых клеток (AsPC-1, BxPC-3, PTJ64i, PTJ86i, HT-29 и SW480) были проанализированы с помощью MTT. Эксперименты проводились путем инкубации клеточных линий в течение 72 ч с бензимидазолами в концентрациях от 0 мкМ (носитель) до 20 мкМ. Рисунок 2 и Таблица 1 показывают результаты, полученные с соединениями, наиболее последовательно активными в протестированных линиях раковых клеток, а именно флубендазол, парбендазол, оксибендазол, мебендазол, альбендазол и фенбендазол.
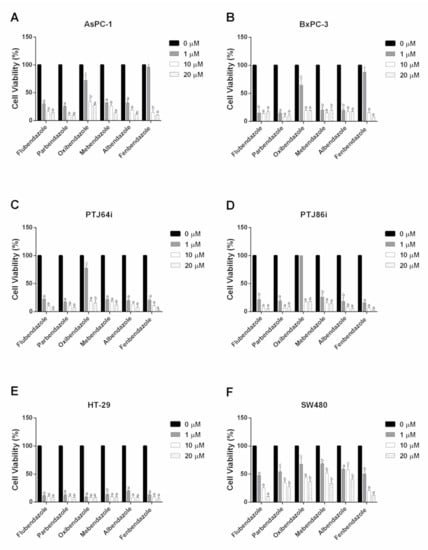
Рисунок 2. Влияние флубендазола, парбендазола, оксибендазола, мебендазола, альбендазола и фенбендазола на жизнеспособность линий клеток рака поджелудочной железы ( A , B ), параганглиомы ( C , D ) и колоректального рака ( E , F ). Жизнеспособность клеток оценивали с помощью 72-часового анализа МТТ с использованием различных концентраций препаратов, как указано. Представленные данные представляют собой средние значения ± SD двух-четырех независимых экспериментов с пятикратными определениями. Сообщается о статистически значимых различиях между контролем (0 мкМ) и каждой концентрацией препарата (c = p < 0,05; b = p < 0,01; a = p < 0,001).
Таблица 1. Значения IC50 шести наиболее активных бензимидазолов на клеточных линиях рака поджелудочной железы, параганглиомы и колоректального рака.

В частности, шесть наиболее мощных соединений имели значения полумаксимальной ингибирующей концентрации (IC 50 ) в диапазоне от 0,01 мкМ до 3,26 мкМ, с показателями ингибирования от 72% до 92% в двух линиях клеток рака поджелудочной железы ( Рисунок 2 A, B и Таблица 1 ). В соответствии с этими результатами, те же бензимидазолы показали значения IC 50 в диапазоне от 0,01 мкМ до 3,29 мкМ и показатели ингибирования от 82% до 97%, также в линиях клеток параганглиомы ( Рисунок 2 C, D и Таблица 1 ). Примечательно, что в последних клетках флубендазол и фенбендазол показали наиболее резкое и последовательное воздействие на жизнеспособность клеток при 20 мкМ, с показателями ингибирования в диапазоне от 95% до 97% ( Рисунок 2 C, D). Что касается линий клеток колоректального рака, шесть соединений показали самые низкие значения IC 50 , которые варьировались от 0,01 мкМ до 1,26 мкМ, но они продемонстрировали различную эффективность в двух линиях клеток ( Рисунок 2 E, F и Таблица 1 ). Фактически, ингибирование жизнеспособности клеток было более выражено в HT-29, где большинство соединений имели самые низкие значения IC 50 , вместе с высокими показателями ингибирования в диапазоне от 91% до 94% ( Рисунок 2 E и Таблица 1 ). Напротив, в SW480 шесть бензимидазолов показали менее последовательные эффекты. В частности, парбендазол, оксибендазол, мебендазол и альбендазол вызывали менее выраженное снижение жизнеспособности клеток при 20 мкМ (степень ингибирования от 59% до 72%), тогда как флубендазол и фенбендазол влияли на жизнеспособность клеток со степенью ингибирования 91% и 87% соответственно ( Рисунок 2 F и Таблица 1 ). В этой связи следует отметить, что низкие значения IC50 не всегда отражают максимальное ингибирование жизнеспособности клеток, поскольку мощный эффект, достигаемый при более низкой концентрации, не всегда может сопровождаться большим эффектом при более высоких концентрациях препарата.
Интересно, что флубендазол, парбендазол, оксибендазол, мебендазол, альбендазол и фенбендазол повлияли на жизнеспособность линий раковых клеток со значениями IC50 в пределах или даже ниже концентраций в плазме, достигаемых препаратами в стандартных терапевтических дозах, что подтверждает их значимость в контексте клинической трансляции [ 7 , 30 ].
Что касается рикобендазола и оксфендазола, ключевых метаболитов альбендазола и фенбендазола, соответственно, они представляют собой стереогенный центр (например, атом серы сульфонильной группы) и, следовательно, состоят из эквимолярной смеси энантиомеров. Что касается других хиральных фармацевтических молекул, энантиомеры двух сульфоксидов могут проявлять различные фармакологические свойства. В связи с этим исследования in vivo показали, что противопаразитарная активность энантиомера ( R )-рикобендазола выше, чем у его аналога ( S )-рикобендазола [ 24 ]. Более того, накопление ( R )-рикобендазола наблюдалось в спинномозговой жидкости пациентов с нейроцистицеркозом [ 31 ]. Эта стереоселективность во взаимодействии препарата с организмом побудила нас исследовать in vitro антипролиферативную активность сульфоксидов с использованием их индивидуальных энантиомеров, а не рацемических форм.
Ранее мы описали разделение методом ВЭЖХ энантиомеров хиральных сульфоксидов рикобендазола и оксфендазола на хиральных неподвижных фазах на основе полисахаридов [ 32 ]. В частности, хорошее энантиоразделение может быть достигнуто с использованием иммобилизованной хиральной неподвижной фазы Chiralpak IG на основе амилозы в нормальных фазовых и полярных органических условиях [ 32 ]. В настоящем исследовании использовалась колонка Chiralpak IG размером 250 мм × 10 мм с внутренним диаметром [ 33 , 34 ] для оптимизации и выделения многомилиграммовых количеств энантиочистых форм рикобендазола (как ранее сообщалось для оксфендазола). Хроматограммы, изображенные на рисунке 3, являются репрезентативными для возрастающих количеств рикобендазола (RBZ), разделенных за один хроматографический цикл. Примечательно, что для образца загрузки 17 мг рикобендазола, растворенного в 5 мл метанола/ацетона 10:1 ( об. / об. ), было возможно базовое фракционирование двух энантиомеров.

Рисунок 3. Исследование загрузки рикобендазола ( RBZ ) на колонку Chiralpak IG. Условия хроматографирования: колонка Chiralpak IG (250 мм × 10 мм id); подвижная фаза, метанол-ацетонитрил 50:50; скорость потока, 5,5 мл/мин; температура колонки, 40 °C; детектирование: УФ при 310 нм.
Два энантиомера были выделены с энантиомерным избытком (ee) >99% и с восстановлением 90-95%. Таким образом, учитывая, что время анализа составило 12 мин, в общей сложности 240 мг рацемического образца удалось разделить за 24 ч. Стоит подчеркнуть, что первый собранный энантиомер имеет ( R ) абсолютную конфигурацию, которая является стереохимией, описанной для реализации активности потенциальных новых препаратов для лечения гельминтозов человека.
В целом, две пары энантиомеров продемонстрировали менее выраженные и однородные антипролиферативные эффекты против шести линий раковых клеток по сравнению с наиболее активными аналогами в Таблице 1 ( Рисунок 4 и Таблица 2 ). Следует отметить, что ( R )-рикобендазол и ( R )-оксфендазол вызвали выраженное ингибирование жизнеспособности клеток рака поджелудочной железы AsPC-1 и BxPC-3, при этом значения IC50 варьировались от 1,18 мкМ до 13,6 мкМ ( Таблица 2 и Рисунок 4 A,B). Кроме того, ( R )-оксфендазол также был последовательно активен в снижении жизнеспособности линий клеток параганглиомы PTJ64i e PTJ86i со значениями IC 50 10,02 мкМ и 12,41 мкМ соответственно, а также в линии клеток колоректального рака HT-29, демонстрируя IC 50 10,02 мкМ. С другой стороны, ни один из энантиомеров не имел значений IC 50 ниже 20 мкМ в линии клеток колоректального рака SW480, что позволяет предположить, что эта линия клеток довольно устойчива к этой серии соединений ( Рисунок 4 и Таблица 2 ). В целом следует отметить, что как ( S )-рикобендазол, так и ( S )-оксфендазол продемонстрировали слабую ингибирующую активность в отношении жизнеспособности шести протестированных линий клеток, на что указывают их значения IC50, превышающие 20 мкМ, что указывает на то, что антипролиферативные эффекты двух ( R )-энантиомеров неизменно более выражены, чем у их аналогов ( S )-энантиомеров в панели линий раковых клеток.
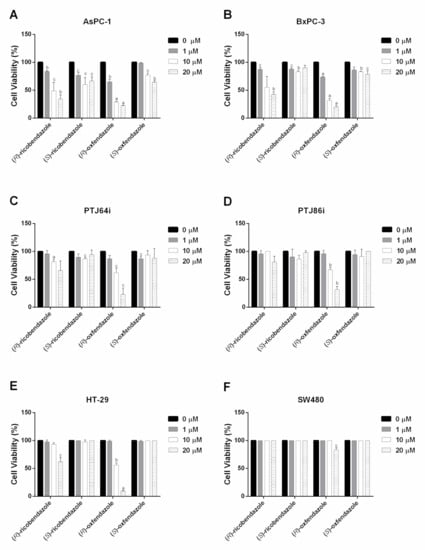
Рисунок 4. Влияние отдельных энантиомеров ( R )-рикобендазола/( S )-рикобендазола и ( R )-оксфендазола/( S )-оксфендазола на жизнеспособность линий клеток опухолей поджелудочной железы ( A , B ), параганглиомы ( C , D ) и колоректальных ( E , F ). Жизнеспособность клеток оценивали с помощью 72-часового анализа МТТ с использованием различных концентраций препаратов, как указано. Представленные данные являются средними значениями ± SD двух-трех независимых экспериментов с пятикратными определениями. Сообщается о статистически значимых различиях между контролем (0 мкМ) и каждой концентрацией препарата (c = p < 0,05; b = p < 0,01; a = p < 0,001).
Таблица 2. Значения IC50 отдельных энантиомеров ( R )-рикобендазола/( S )-рикобендазола и ( R )-оксфендазола/( S )-оксфендазола на линиях клеток рака поджелудочной железы, параганглиомы и колоректального рака.

...Примечательно, что бензимидазолы никогда ранее не тестировались на линиях клеток параганглиомы, и некоторые из них резко и значительно снизили жизнеспособность линии клеток параганглиомы, что является важным результатом в поиске эффективных соединений для лечения этой редкой опухоли, которая плохо поддается стандартной химиотерапии.
...Интересное предсказание, предложенное инструментом SwissADME, относится к отсутствию взаимодействия с гликопротеином проницаемости (P-gp), который способствует оттоку цитотоксических препаратов из клеток, что, в свою очередь, снижает эффективность противоопухолевого лечения. P-gp сверхэкспрессируется в опухолевых клетках и участвует в множественной лекарственной устойчивости [ 35 ]. Интересно, что ни одно из оцененных соединений, по-видимому, не было субстратом этого белка ( таблица 3 ).
Таблица 3. Физико-химические свойства флубендазола ( FLU ), парбендазола ( PAR ), оксибендазола ( OXI ), мебендазола ( MEB ), альбендазола ( ALB ) и фенбендазола ( FEN ), оцененные in silico.



Было предсказано, что фенбендазол может взаимодействовать с MAP-киназой p38 альфа, нарушение регуляции которой было связано с поздними стадиями и короткой выживаемостью у онкологических больных ( таблица 5 ) [ 36 ]. С другой стороны, для мебендазола предполагаемые взаимодействия с тирозин-протеинкиназой ABL и рецептором 2 сосудистого эндотелиального фактора роста были признаны наиболее вероятными ( таблица 6 ). Тирозин-протеинкиназа ABL играет решающую роль в различных ключевых процессах, связанных с ростом и выживанием клеток в ответ на внеклеточные стимулы. Ее сверхэкспрессия часто обнаруживается при хроническом миелоидном лейкозе (ХМЛ) [ 37 ]. Факторы роста сосудистого эндотелия (VEGF) контролируют развитие сосудов посредством связывания с различными рецепторами VEGF (VEGFR). Среди них VEGFR-2 регулирует функции эндотелия сосудов через свои внутриклеточные сигнальные каскады, которые вызывают пролиферацию, миграцию, выживание и повышенную проницаемость, тем самым способствуя ангиогенному ответу [ 38 ]. Ангиогенез является критическим этапом развития опухоли, поскольку раковые клетки имеют высокие метаболические потребности в кислороде и питательных веществах, необходимых для питания аномального роста. Таким образом, ингибирование рецептора VEGF-2 может быть эффективным для нарушения васкуляризации опухоли, а также для содействия «нормальной» сосудистой сети внутри опухоли и обеспечения эффективной доставки противоопухолевых препаратов.
Удивительно, но хотя тубулин млекопитающих присутствует в базе данных белков SwissADME, он не был идентифицирован веб-инструментом как мишень для бензимидазолов, несмотря на несколько исследований, сообщающих о его значимости в качестве молекулярной мишени для объяснения противоопухолевых свойств этих соединений [ 12 , 16 , 17 ]. Однако следует учитывать, что перепрофилированные препараты могут модулировать множественные пути в раковых клетках; таким образом, интересно, что в прогнозировании мишеней SwissADME появились дополнительные мишени, связанные с раком, отличные от тубулина, которые могут способствовать противораковому действию бензимидазолов. Таким образом, будет обязательно проверить предсказанные, ранее неизвестные молекулярные мишени этих соединений в будущих исследованиях in vitro и in vivo, ввиду потенциальных ценных полифармакологических профилей бензимидазолов, которые будут использоваться при лечении рака.
4. Выводы
Было признано, что несколько антигельминтных соединений на основе бензимидазола оказывают противоопухолевое действие с выраженной селективностью к раковым клеткам. В настоящем исследовании мы изучили влияние большого ряда антигельминтных средств на основе бензимидазола и их энантиомеров на жизнеспособность различных опухолевых клеток, включая параганглиому, а также клеточные линии рака поджелудочной железы и колоректального рака. Шесть бензимидазолов, а именно флубендазол, парбендазол, оксибендазол, мебендазол, альбендазол и фенбендазол, оказались наиболее активными соединениями с постоянным антипролиферативным действием на протестированных линиях раковых клеток и значениями IC50 в низком микромолярном диапазоне или даже в наномолярном диапазоне. Интересно, что оценка in silico их физико-химических, фармакокинетических и лекарственных химических свойств предсказала потенциал этих шести соединений как кандидатов для повторного использования в качестве пероральных препаратов для лечения рака у людей. Более того, эти анализы предсказали отсутствие взаимодействия шести наиболее мощных бензимидазолов с гликопротеином проницаемости P-gp, ответственным за отток лекарств в опухолях, и умеренную или хорошую пероральную биодоступность. В частности, для двух производных фенбендазола и мебендазола анализ прогнозирования целей указал на несколько молекулярных мишеней, связанных с раком, имеющих очень высокие баллы вероятности, что предполагает полифармакологические профили этих препаратов. Эти биоинформационные прогнозы должны быть подтверждены в будущих исследованиях, чтобы расширить наши представления о терапевтической значимости антигельминтиков на основе бензимидазола как кандидатов для повторного использования в терапии рака.
Screening of Benzimidazole-Based Anthelmintics and Their Enantiomers as Repurposed Drug Candidates in Cancer Therapy
Repurposing of approved non-antitumor drugs represents a promising and affordable strategy that may help to increase the repertoire of effective anticancer drugs. Benzimidazole-based anthelmintics are antiparasitic drugs commonly employed both in human and veterinary medicine. Benzimidazole...
www.mdpi.com
Обзор противоопухолевых свойств перепрофилированных препаратов
В связи с тем, что участились просьбы дать ссылки на научные статьи и исследования по применению тех или иных перепрофилированных препаратов против рака, сделал этот пост на основе публикаций в моем ЖЖ. Возможно всё не удастся втиснуть в один пост из-за ограничений по количеству знаков (лимит 80К знаков), но можно будет воспользоваться «поиском» у меня в ЖЖ по ключевым словам для получения дополнительной информации.
https://budetlyanin108.livejournal.com/3655521.html
Обновление по дозировкам фенбендазола при раке от Др. У.Макиса:
https://budetlyanin108.livejournal.com/3758501.html?newpost=1